I. Mở đầu
Mỗi năm, bệnh gan trở thành một gánh nặng y tế toàn thế giới với > 1 triệu ca tử trận. Trong những nguyên do của bệnh gan, bệnh gan nhiễm mỡ không do rượu ( NAFLD ) là nguyên do chính trên toàn quốc tế .
BS NGUYỄN THANH HIỀN
BS DƯƠNG NGỌC HUY HOÀNG
Tỷ lệ mắc NAFLD cao cùng các yếu tố nguy cơ chuyển hóa tim mạch như béo phì, đái tháo đường, hội chứng chuyển hóa và rối loạn lipid máu trong dân số chung. NAFLD không chỉ liên quan đến tăng nguy cơ xơ gan và ung thư biểu mô tế bào gan, mà còn làm tăng nguy cơ biến cố tim mạch. Rung nhĩ (AF) và bệnh gan, đặc biệt là NAFLD, có chung nhiều yếu tố nguy cơ, vì thế AF thường xuyên xuất hiện ở những bệnh nhân này. Hơn nữa, với viêm hệ thống dai dẳng, tuổi cao, bất động kéo dài, tăng nồng độ estrogen và giảm tổng hợp thuốc chống đông máu nội sinh trong bệnh gan, bệnh nhân với bệnh gan cũng có nguy cơ tăng huyết khối tĩnh mạch (VTE).
Người bệnh gan kèm AF và/hoặc VTE cần sử dụng thuốc chống đông máu đường uống (OACs) để phòng ngừa các biến cố huyết khối.Tuy nhiên,việc sử dụng OAC trong bệnh gan rất phức tạp do mất cân bằng các yếu tố tiền đông máu nội sinh và chống đông máu. Hiểu biết về rối loạn đông máu trongbệnh gan đã có bước tiến triển mạnh mẽ trong hơn 2 thập kỷ qua. Lúc đầu, bệnh nhân mắc bệnh gan tiến triển, đặc biệt với sự tăng INR, đã được xem xét là tăng nguy cơ chảy máu và nguy cơ huyết khối thấp. Tuy nhiên, dữ liệu gần đây đã cho thấy có sự gia tăng tỷ lệ biến chứng huyết khối ở những bệnh nhân này.
Warfarin và các loại thuốc NOACs đã được chứng minh là làm giảm đột quỵ và huyết khối một cách an toàn trên nhóm bệnh nhân bị AF và VTE. Tuy nhiên, bệnh nhân mắc bệnh gan hầu như là tiêu chuẩn loại trừ trong các thử nghiệm lâm sàng ngẫu nhiên về OAC để phòng ngừa đột quỵ và VTE. Hơn nữa, vì tất cả NOAC chuyển hóa đáng kể ở gan, nên suy giảm chức năng gan có thể dẫn đến tăng nồng độ thuốc, giảm yếu tố đông máu, và kèm nhiều nguy cơ chảy máu. Ngoài ra, một số NOAC chuyển hóa phụ thuộc vào enzym cytochrom P450, và hoạt động của những enzyme này có thể bị thay đổi trong bệnh gan. Do đó, chiến lược chống đông máu tối ưu cho bệnh nhân mắc AF và VTE có bệnh gan đồng thời rất phức tạp và chưa được định rõ. Trong bài này, chúng tôi thảo luận về lợi ích – nguy cơ, dược động học, quan sát và dữ liệu thử nghiệm về điều trị chống đông đường uống ở bệnh nhân mắc bệnh gan, nhấn mạnh vào việc phòng ngừa và điều trị biến cố huyết khối ở bệnh nhân AF và VTE. Chúng tôi đưa ra một cách tiếp cận thực tế để lựa chọn bệnh nhân, lựa chọn OAC và chiến lược giảm chảy máu ở bệnh nhân với bệnh gan cần điều trị OAC.
II. Rối loạn đông máu và bệnh gan
II.1. Gánh nặng của biến chứng huyết khối ở bệnh nhân có bệnh gan.
Một số nghiên cứu quan sát trong dân số chung cho thấy bệnh nhân bị bệnh gan phải đối mặt với tăng nguy cơ đột quỵ thiếu máu và VTE so với bệnh nhân không có bệnh gan.Trong một phân tích hồi cứu của 289.559 bệnh nhân bị AF từ Nghiên cứu Bảo hiểm Y tế Quốc gia Cơ sở dữ liệu tại Đài Loan, hiện diện của bệnh xơ gan làm nguy cơ đột quỵ do thiếu máu cục bộ cao hơn so với bệnh nhân không bị xơ gan. Tương tự, phân tích tổng hợp 9 nghiên cứu quan sát cho thấy nguy cơ cao gấp 2,5 lần đột quỵ thiếu máu cục bộ ở bệnh nhân mắc bệnh gan so với bệnh nhân không mắc bệnh gan.
Một số nghiên cứu cũng cho thấy nguy cơ gia tăng VTE ở bệnh nhân suy chức năng gan. Ví dụ, trong một nghiên cứu của Đan Mạch trên100.000 bệnh nhân bị VTE, hiện diện của bệnh gan liên quan độc lập với tăng gần 2 lần nguy cơ VTE so với bệnh nhân không có bệnh gan. Quan trọng, sự tiến triểnVTE ở bệnh nhân xơ gan có tỷ lệ tử vong trong 30 ngày cao gấp 2 lần so với bệnh nhân không bị xơ gan. Ngoài nguy cơ huyết khối tĩnh mạch sâu và tắc mạch phổi, bệnh nhân mắc bệnh gan còn có nguy cơ huyết khối tĩnh mạch cửa (PVT) cao hơn do dòng chảy chậm đi trong các mạch máu lách, nhiễm trùng trong ổ bụng, viêm và chèn ép từ lách to và cổ trướng. Các nghiên cứu đã báo cáo tỷ lệ mắc PVT từ 8% đến 18% ở bệnh nhân xơ gan, do đó PVT thành biểu hiện huyết khối phổ biến nhất ở bệnh nhân mắc bệnh gan. Sự phát triển của PVT là một dấu hiệu tiên lượng xấu ở bệnh nhân mắc bệnh gan. Trong một nghiên cứu quan sát tiến cứu trên 1.243 bệnh nhân bị xơ gan, PVT xảy ra ở 11% bệnh nhân sau 5 năm và liên quan độc lập đến sự hiện diện các biểu hiện nặng của bệnh gan, như giãn tĩnh mạch thực quản và rối loạn đông máu từ gan. Vì thế, bệnh nhân mắc bệnh gan phải đối mặt với nguy cơ cao về các biến cố huyết khối và phòng ngừa các biến chứng này là một mục tiêu điều trị quan trọng.
II.2. Cơ chế chảy máu và tạo huyết khối ở bệnh nhân bệnh gan.
Chức năng gan bình thường là then chốt trong việc duy trì sự cân bằng giữa cầm máu và phòng ngừa huyết khối. Tuy nhiên, mối quan hệ giữa bệnh gan và con đường đông máu rất phức tạp do tác động đa dạng của nó đối với tiểu cầu, các yếu tố đông máu, các chất ức chế tự nhiên (antithrombin, protein C, và protein S), và tiêu sợi huyết (Hình 1).Bệnh gan có liên quan đến tăng nguy cơ huyết khối do giảm chống đông máu nội sinh và nồng độ chất tiền đông máu cao. Việc giảm sản xuất protein C và antithrombin là yếu tố thúc đẩy nguy cơ huyết khối ở bệnh nhân mắc bệnh gan. Ngoài ra, bệnh nhân mắc bệnh gan cũng dễ bị huyết khối thứ phát do tăng kết tập tiểu cầu liên quan đến hoạt động mạnh của yếu tố von Willebrand và nồng độ ADAMTS13 thấp, một chất thay đổi hoạt động của yếu tố von Willebrand. Nồng độ plasminogen thấp gây ra tình trạng giảm quá trình tiêu sợi huyết khiến bệnh nhân có khuynh hướng bị huyết khối. Thời gian prothrombin (PT) kéo dài gặp phổ biến trong bệnh gan tiến triển. Mức INR> 2.0 trước đây được cho là mức bảo vệ khỏi VTE; tuy nhiên, những quan sát gần đây đã bác bỏ điều này và đã cho thấy nguy cơ cao của VTE ngay cả ở những bệnh nhân có INR tăng.
Hơn nữa, như chúng ta đã biết bệnh gan có liên quan đến tăng nguy cơ chảy máu vì tất cả các yếu tố đông máu (ngoại trừ yếu tố VIII và yếu tố von Willebrand) được tổng hợp ở gan; do đó, sự tổng hợp các yếu tố này sẽ giảm trong bệnh gan. Giảm lượng fibrinogen và các yếu tố II, V, VII và X được biểu hiện bằng kéo dài PT, trong khi giảm hoạt động của fibrinogen và các yếu tố đông máu II, V, IX,X, XI và XII dẫn đến kéo dài aPTT. Nguy cơ chảy máu tăng thêm do giảm tiểu cầu liên quan đến giảm sản xuất thrombopoietin. Ngoài ra, bệnh gan cũng có liên quan đến tăng tiêu sợi huyết thứ phát do tăng chất hoạt hóa plasminogenmô và giảm ức chế plasmin và ức chế tiêu sợi huyết kích hoạt thrombin (TAF)
III. WARFARIN trong bệnh gan.
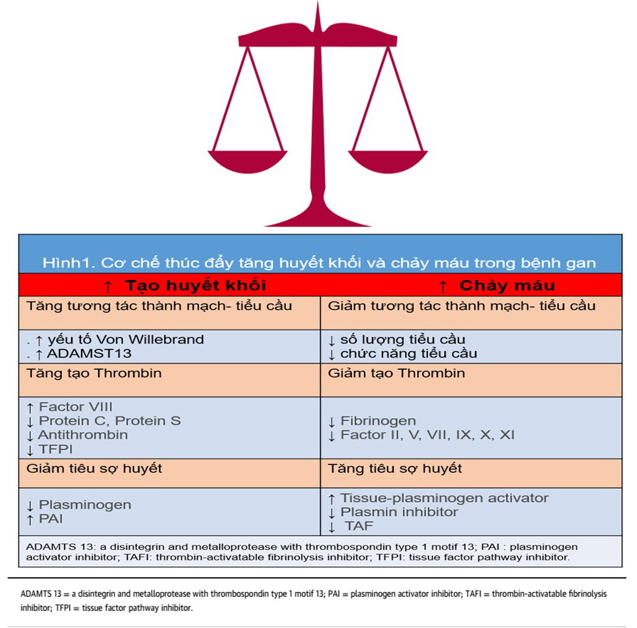
Hình 1. Cơ chế tăng huyết khối và chảy máu trong bệnh gan
. Warfarin là OAC tầm cỡ được lựa chọn để điều trị và phòng ngừa những biến chứng huyết khối trong bệnh gan. Warfarin ức chế sự tổng hợp phụ thuộc vào vitamin K của những yếu tố đông máu II, VII, IX và X trong gan. Nó cũng làm giảm sản xuất protein chống đông máu như protein C và S. Nó đạt được gần như trọn vẹn sinh khả dụng đường uống và đạt nồng độ đỉnh trong huyết tương trong 2 đến 6 giờ. Nó hoàn toàn có thể tích phân phối nhỏ ( 0,14 l / kg ) với protein kết nối trong huyết tương ( # 99 % ). Thời gian bán hủy của warfarin là 20 đến 60 h. Thuốc bị vô hiệu đa phần bởi gan, do được quy đổi thành chất chuyển hóa không hoạt động giải trí trải qua chuyển hóa phụ thuộc vào cytochrom P450 và không thải qua thận. Sử dụng warfarin trong thực hành thực tế lâm sàng thường quy là một thử thách vì cửa số điều trị hẹp, đặc biệt quan trọng ở những bệnh nhân mắc bệnh gan. Warfarin có xu thế tương tác thuốc-thuốc đáng kể vì sự trao đổi chất của nó trải qua mạng lưới hệ thống cytochrom P450, do đó dễ gây vượt ngưỡng hoặc dưới ngưỡng điều trị theo INR. Đặc tính này hoàn toàn có thể gây bất lợi ở những bệnh nhân mắc bệnh gan có rủi ro tiềm ẩn cao bị chảy máu và huyết khối. Theo guideline về AF và VTE trong dân số chung, INR từ 2.0 đến 3.0 được coi là tối ưu để ngăn ngừa những biến cố huyết khối. Tuy nhiên, không có guideline đơn cử nào hướng dẫn sử dụng warfarin ở bệnh nhân suy tính năng gan. Bệnh nhân mắc bệnh gan hoàn toàn có thể đã có mức INR tăng cao. Vì thế, liều warfarin và mức INR tiềm năng không được xác lập rõ trong trường hợp này. Liều thấp hoàn toàn có thể dẫn đến tăng nguy cơ biến cố huyết khối, và khi kiểm soát và điều chỉnh liều nếu INR vượt ngưỡng điều trị hoàn toàn có thể dẫn đến biến cố chảy máu. Bệnh nhân mắc bệnh gan có sự ngày càng tăng gấp 2 lần tỷ suất chảy máu so với bệnh nhân không mắc bệnh gan và hoàn toàn có thể bị tác động ảnh hưởng đáng kể bởi những yếu tố như albumin huyết thanh và tính năng thận .
Cho đến nay, chưa có thử nghiệm lâm sàng tiền cứu nào kiểm tra tính an toàn và hiệu quả của warfarin trong việc giảm các biến cố huyết khối ở bệnh nhân mắc bệnh gan và hầu hết dữ liệu về sử dụng warfarin đã được lấy từ các nghiên cứu quan sát hồi cứu. Các nghiên cứu quan sát đều cho thấy nguy cơ huyết khối tắc mạch bằng warfarin thấp hơn so với không dùng liệu pháp chống đông máu. Trong một phân tích 10.336 bệnh nhân bị xơ gan có CHA2DS2-VASc≥ 2 ở Đài Loan, warfarin giảm 24% nguy cơ đột quỵ do thiếu máu cục bộ so với khi không điều trị chống huyết khối. Ngoài ra, warfarin có thể có hiệu quả trong điều trị PVT ở bệnh nhân mắc bệnh gan. Trong một nghiên cứu đoàn hệ hồi cứu bao gồm 28 bệnh nhânvới PVT, liệu pháp chống đông máu bằng warfarin duy trì chỉ số từ 2.0 đến 3.0 dẫn đến tỷ lệ tái thông tĩnh mạch cửa cao hơn và tỷ lệ huyết khối tái phát thấp hơn so với không dùng thuốc chống đông máu. Tương tự, trong một loạt trường hợp55 bệnh nhân bị xơ gan và PVT, khởi đầu sớm warfarin làm tái thông đáng kể tĩnh mạch cửa. Tuy nhiên, việc chống đông bằng warfarin có liên quan đến xuất huyết tiêu hóa ở 5 bệnh nhân (9%) được cho là do giãn tĩnh mạch thực quản mức độ nặng.
Mặc dù warfarin có thể làm giảm nguy cơ thuyên tắc huyết khối ở bệnh nhân suy chức năng gan, nó có một số hạn chế trong thực hành lâm sàng, bao gồm nhu cầu theo dõi chỉ số INR thường xuyên, tương tác với chế độ ăn uống và thuốc, thay đổi đáp ứng thuốc giữa các cá thể, cũng như tỷ lệ xuất huyết và tử vong cao hơn so với NOAC, như đã được chứng minh trong các thử nghiệm ngẫu nhiên của bệnh nhân với AF và VTE
IV. Sử dụng NOACs ở người bệnh gan.
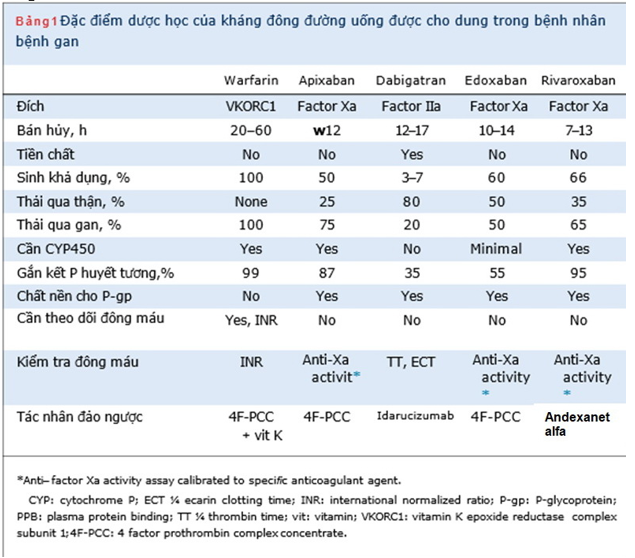
Trong thập kỷ qua, NOAC đã nổi lên như một sự thay thế đầy hứa hẹn cho warfarin để phòng ngừa và điều trị VTE và phòng ngừa đột quỵ ởbệnh nhân bị AF (Bảng 1). Một số thử nghiệm ngẫu nhiên về apixaban, dabigatran, edoxaban và rivaroxaban đã chứng minh hiệu quả tương đương hoặc vượt trộivà an toàn của NOAC so với warfarin ở những bệnh nhân bị AF hoặc VTE. Do đó, NOAC hiện đangđược khuyến cáo là điều trị đầu tay hoặc thay thế cho warfarin trong điều trị AFvà VTE.
Mặc dù sự an toàn của NOACs ở bệnh nhân suy thận từ nhẹ tới trung bình được bàn luận nhiều, nhưng hiệu quả và độ an toàn của các loại thuốc này trong bệnh gan chưa được nghiên cứu kỹ. Không giống như suy thận có thể dễ dàng phát hiện và theo dõi bằng cách đo độ thanh thải creatinin để hướng dẫn liều dùng thuốc, bệnh gan có thể không bị phát hiện cho đến khi nó tiến tới giai đoạn nặng gây tăng INR hoặc các bất thường khác trong kết quả xét nghiệm. Không giống như hướng dẫn sử dụng NOACs trong bệnh thận, không có guideline thực hành lâm sàng nào đưa ra hướng trực tiếp sử dụngnhững thuốc này ở bệnh nhân mắc bệnh gan.
Bảng 1. Đặc điểm dược lực học các thuốc OAC
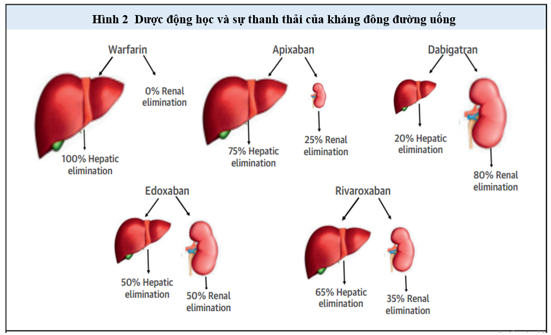
Hình 2. Dược động học và thanh thải của OAC.
Tất cả những NOAC đều trải qua một phần chuyển hóa ở gan ; do đó, bất kể sự suy giảm tính năng gan đều hoàn toàn có thể ảnh hưởng tác động đến công dụng của những thuốc này ( Hình 2 ). Hơn nữa, hiện hữu của rối loạn đông máu do gan sẽ khuyếch đại rủi ro tiềm ẩn chảy máu ở bệnh nhân được điều trị với NOAC. Bệnh nhân mắc bệnh gan thường là tiêu chuẩn loại trừ của những nghiên cứu và điều tra ngẫu nhiên. Do đó, về mặt bằng chứng tương quan đến sự bảo đảm an toàn và hiệu suất cao của NOAC ở những bệnh nhân bị suy giảm công dụng gan đa phần gồm có những nghiên cứu và điều tra dược động học, báo cáo giải trình từng case và điều tra và nghiên cứu quan sát nhỏ .
IV. 1. Dược lực học và dược động học của NOACs:
Bệnh gan có thể ảnh hưởng đến một số khía cạnh của dược động học NOAC, bao gồm đào thải thuốc sau khi uống, gắn kết protein huyết tương, chuyển hóa qua trung gian cytochrom P450, bài tiết mật, và ảnh hưởng đến chức năng thận. Trong số NOACs, apixaban thải qua gan nhiều nhất (75%), tiếp theo là rivaroxaban (65%) và edoxaban (50%). Trong số các NOAC, chỉ có dabigatran etexilate là một tiền chất; sự biến đổi sinh học của dabigatran etexilate thành dạng hoạt động xảy ra nhờ các men esterase khắp nơi trong cơ thể; do đó, sự chuyển hóa không giới hạn ở gan. Vì tổng hợp albumin bị giảm trong bệnh gan, tỷ lệ thuốc tự do trong huyết tương tăng. Các protein gắn kết trong huyết tương của rivaroxaban, apixaban, edoxaban và dabigatran tương ứng khoảng 95%, 85%, 55% và 35%. Hơn nữa, sự hoạt động của enzyme cytochrom P450 và sự bài tiết qua mật giảm trong bệnh gan, do đó dẫn đến giảm độ thanh thải của thuốc trên những con đường này. Không có NOAC nào phụ thuộc hoàn toàn trên các enzyme cytochrom P450 cho quá trình trao đổi chất; tuy nhiên, apixaban và rivaroxaban được chuyển hóa chủ yếu bởi cytochrom P450, trong khi edoxaban và dabigatran chuyển hóa tối thiểu hoặc không qua cytochrom P450.
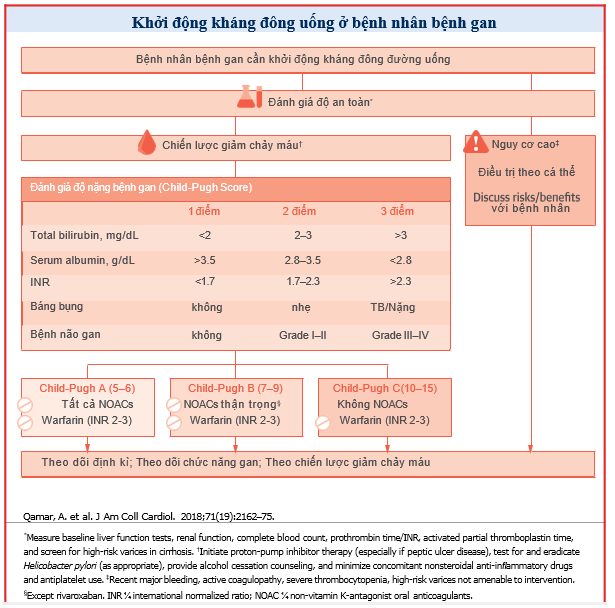
Cơ quan Dược phẩm Châu Âu (EMA) đề nghị quy định sử dụng phân loại ChildPugh phân loại mức độ suy giảm chức năng gan để hướng dẫn dùng thuốc ở bệnh nhân mắc bệnh gan. Nghiên cứu dược động học trong suy gan đã được thực hiệnc ho tất cả các NOAC hiện nay.
Apixaban là một chất ức chế Xa trực tiếp. Sinh khả dụng của nó khoảng 50%, và nó đạt đến nồng độ đỉnh trong huyết tương sau 3 đến 4 giờ sau khi dùng. Thời gian bán hủy của apixaban là khoảng 12h. Ở gan, nó được chuyển hóa chủ yếu thông qua cơ chế phụ thuộc cytochrom P450 và cũng là chất nền cho hệ thống vận chuyển P-glycoprotein.Trong số các NOAC, apixaban ít thải trừ qua thận nhất (25%) (Bảng 1). Trên cơ sở các nghiên cứu dược động học, hiện tại của FDA khuyến cáo không nên điều chỉnh liều apixaban ở bệnh nhân suy gan nhẹ (Child-Pugh A) (Bảng 2). Vì dữ liệu hạn chế và liên quan chảy máu ở bệnh nhân suy gan trung bình (Child-Pugh B), nên thận trọng khi sử dụng apixaban và không được khuyến cáo dùng cho bệnh nhân suy gan nặng (Child-Pugh C). EMA không khuyến cáo sử dụng apixaban ở bệnh nhân mắc bệnh gan liên quan đến rối loạn đông máu và nguy cơ chảy máu liên quan đến lâm sàng (Bảng 2). EMA cũng khuyến nghị kiểm tra chức năng gan trước khi bắt đầu apixaban.
Dabigatran là một chất ức chế trực tiếp thrombin đường uống. Sinh khả dụng của nó là 3% đến 7%, và nó đạt đến nồng độ đỉnh trong huyết tương trong vòng 1 đến 2 giờ sau khi uống. Thời gian bán hủy của dabigatran là 12 đến 17h. Một phần nhỏ dabigatran hấp thu được chuyển hóa thành glucuronide trong gan; tuy nhiên, sự phân chia này không làm thay đổi hoạt động của dabigatran. Hơn nữa, dabigatran được đào thải chủ yếu (80%) qua thận (Bảng 1). Trên cơ sở đánh giá dược động học và dược lực học của dabigatran, FDA khuyến cáo không nên điều chỉnh liều đối với dabigatran ở bệnh nhân suy gan nhẹ hoặc trung bình (Bảng 2).Tuy nhiên, EMA không khuyến cáo dùng dabigatran ở những bệnh nhân có nồng độ men gan cao hơn gấp đôi giới hạn trên bình thường (ULN) và ở những bệnh nhân mắc bệnh gan liên quan tới sống còn (Bảng 2).
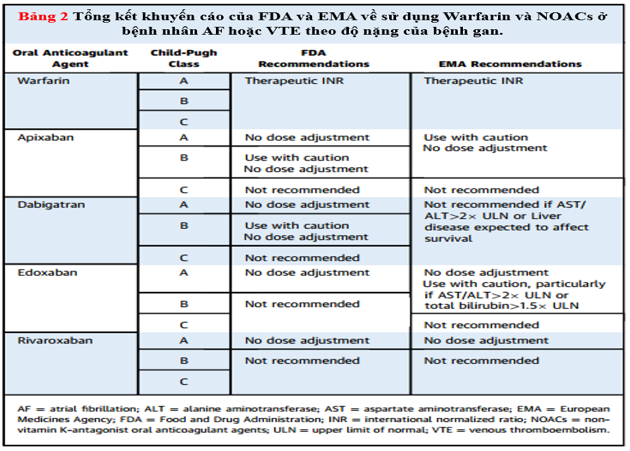
Bảng 2. Tổng hợp khuyến cáo của FDA và EMA về sửu dụng Warfarin và NOAC ở bệnh nhân AF hoặc VTE theo độ nặng của bệnh gan
Edoxaban là một chất ức chế trực tiếpyếu tố Xa đường uống. Sinh khả dụng của thuốc khoảng 60%, và đạt nồng độ đỉnh từ 1 đến 2 h. Thời gian bán hủy của edoxaban là 10 đến 14 h. Chuyển hóa và đào thải của edoxaban như nhau bởi gan (50%) và thận (50%).Trong gan, edoxaban trải qua chuyển hóa tối thiểu (
Rivaroxaban là một chất ức chế Xa trực tiếp. Sinh khả dụng của nó phụ thuộc vào vào liều : so với liều 10 mg, là 80 % đến 100 % và không biến hóa với thức ăn ; so với liều 20 mg, khoảng chừng 66 % và tăng khi dùng với thức ăn. Rivaroxaban đạt được mức cao nhất trong 2 đến 4 giờ và thời hạn bán hủy của nó là 7 đến 13 giờ. Một phần ba của Rivaroxaban được thải qua thận và hai phần ba trải qua quy trình chuyển hóa ở gan ( Bảng 1 ). Trên cơ sở tài liệu dược động học và dược lực học, FDA và EMA không khuyến nghị sử dụng Rivaroxaban ở bệnh nhân suy gan trung bình ( Child-Pugh B ) hoặc suy gan nặng ( Child-Pugh C ) hoặc ở bệnh nhân mắc bệnh gan tương quan đến rối loạn đông máu ( Bảng 2 ) .
IV. 2. Các nghiên cứu quan sát dùng NOAC/bệnh gan
Mặc dù NOAC đang được sử dụng rộng rãi trong các nhóm bệnh nhân AF hoặc VTE, nhưng dữ liệu rất hạn chế về an toàn và hiệu quả của các thuốc này ở bệnh nhân mắc bệnh gan. Cho đến nay, kinh nghiệm sử dụng NOAC ở bệnh nhân mắc bệnh gan đều dưới dạng báo cáo ca bệnh, loạt ca bệnh, và những nghiên cứu quan sát nhỏ. Trong một phân tích hồi cứu đơn trung tâm của 39 bệnh nhân mắc bệnh gan, Intagliata et al. so sánh bệnh nhân dùng NOAC với bệnh nhân được điều trị chống đông máu tiêu chuẩn và được tìm thấykhông có sự khác biệt đáng kể về nguy cơ chảy máu lớn giữa 2 nhóm sau 1 năm. Có 1 người tử vong trong nhóm warfarin gây ra bởi chảy máu nội sọ.
Trong nghiên cứu và phân tích loạt trường hợp 94 bệnh nhân bị suy gan nhẹ hoặc trung bình ( Child-Pugh A hoặc B ) được kê đơn NOAC ( 83 % Rivaroxaban, 11 % dabigatran và 6 % apixaban ) để điều trị VTE ( 75 % PVT và5 % DVT ) hoặc AF ( 14 % ), chảy máu cần phải ngừng thuốc chống đông máu xảy ra ở 5 % bệnh nhân theo dõi trung bình 21 tháng. Không quan sát thấy chảy máu gây tử trận hoặc xuất huyết nội sọ hoặc tổn thương gan do NOAC. Một điều tra và nghiên cứu đoàn hệ hồi cứu gần đây trên 45 bệnh nhân bị xơ gan đang dùng OAC ( Rivaroxaban, n = 17 ; apixaban, n = 10 ; warfarin, n = 15 ; enoxaparin, n = 3 ) để điều trị VTE hoặc phòng ngừa đột quỵ ở AF cho thấy tỉ lệ chảy máu lớn ở bệnh nhân dùng NOAC thấp hơn so với bệnh nhân dùng warfarin hoặc enoxaparin trong 3 năm ( 4 % so với 28 % ). Không có sự độc lạ về nguy cơ biến cố huyết khối giữa 2 nhóm. Ở bệnh nhân bị xơ gan và PVT, nghiên cứu và điều tra trên 50 bệnh nhân cho thấy tỉ lệ điều trị thành công xuất sắc PVT cao hơn sau 6 tháng ở những người được điều trị bằng edoxaban so với warfarin ( tiềm năng INR 1,5 đến 2,0 ) ( 70 % so với 20 % ). Không có sự độc lạ đáng kể về tỷ suất chảy máu giữa 2 nhóm. Tuy nhiên những nghiên cứu và điều tra trên là quá nhỏ và tất cả chúng ta cần những thử nghiệm lâm sàng ngẫu nhiên ( RCT ) trong nhóm bệnh nhân có rủi ro tiềm ẩn cao này .
V. OACs và nguy cơ tổn thương gan.
Khả năng gây độc cho gan với warfarin là rất hiếm và đã được theo dõi trong quy trình sử dụng lâm sàng trong vài thập kỷ qua. Tuy nhiên với NOAC còn hạn chế do thời hạn dùng chưa đủ lâu. Mối quan ngại về rủi ro tiềm ẩn tổn thương gan khi sử dụng NOAC mở màn với ximelagatran, một chất ức chế thrombin trực tiếp đường uống được nhìn nhận thoáng đãng để phòng ngừa huyết khối và được phát hiện gây tổn thương gan nghiêm trọng ( mức alanine aminotransferase > 3 lần số lượng giới hạn trên mức thông thường trong 8 % bệnh nhân điều trị ). Vì những lo lắng này, nên ximelagatran đã bị dừng lại và nhanh gọn được rút khỏi thị trường. Độ bảo đảm an toàn ở gan của warfarin và những NOAC khác đã được theo dõi ngặt nghèo trong toàn bộ những thử nghiệm ngẫu nhiên gần đây và không có sự độc lạ về tỷ suất nhiễm độc gan giữa warfarin và NOACs ( Bảng 3 ) .
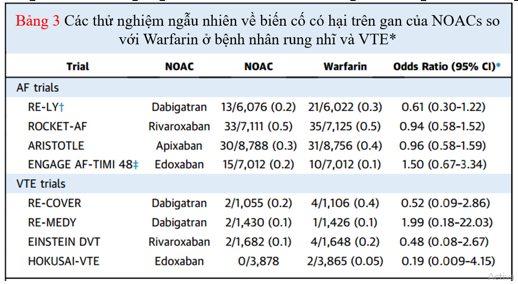
Bảng 3. Nhiễm độc gan giữa warfarin và NOACs trong các thử nghiệm lâm sàng
Dù tổn thương gan do thuốc là rất hiếm, nhưng khả năng gây độc cho gan của NOAC cần phải được theo dõi chặt chẽ trong thời gian dài hơn thông qua các nỗ lực giám sát. Hướng dẫn của Hiệp hội Nhịp tim châu Âu đề nghị theo dõi hàng năm các xét nghiệm chức năng gan ở bệnh nhân được điều trị với NOAC. Tất cả các NOAC đều cho thấy có sự kết hợp với tăng transaminase. Trong một phân tích với 113.717 bệnh nhân mắc AF đã sử dụng OAC (50% warfarin và 50% NOAC), có 7 trường hợp nhập viện vì tổn thương gan trên 1.000 người trong thời gian theo dõi trung bình 14 tháng. So với bệnh nhân dùng warfarin, tỷ lệ tổn thương gan thấp hơn ở những bệnh nhân dùng NOAC (9 so với 5 trên 1.000 người). Trong số các NOAC, dabigatran có liên quan với nguy cơ tổn thương gan thấp nhất. Tương tự, phân tích tổng hợp 29 thử nghiệm ngẫu nhiên so sánhNOAC với liệu pháp chống đông máu tiêu chuẩn hoặc giả dược cho thấy không có sự gia tăng các biến cố gan vớiNOAC.
Gần đây, một nghiên cứu đoàn hệ liên kết với cơ sở dữ liệu Canada đã kiểm tra sự an toàn của gan đối với OAC ở 51.887 bệnh nhân mắc AF (bao gồm 3.778 bệnh nhân mắc bệnh gan comorid) nơi theo dõi 68.739 người- năm. Nghiên cứu cho thấy không có sự khác biệt đáng kể về tỷ lệ tổn thương gan nghiêm trọng với NOAC so với warfarin ở bệnh nhân có hoặc không có bệnh gan.
Mặc dù những kết quả này đảm bảo về sự an toàn của NOAC trên gan, nhưng việc đánh giá an toàn gan của NOAC ở bệnh nhân mắc bệnh ganvẫn cần một nghiên cứu đầy đủ.
VI. Bảo vệ dạ dày ở những bệnh nhân bệnh gan có sử dụng OACs
Hầu hết chảy máu ở bệnh nhân mắc bệnh gan là nguồn gốc đường tiêu hóa và thường quy cho do giãn tĩnh mạch thực quản, bệnh lý dạ dày do tăng áp cửa, bệnh loét dạ dày và dị dạng động tĩnh mạch. Chảy máu tiếp tục hơn ở những bệnh nhân suy gan nặng ( Child-Pugh C ) so với suy gan nhẹ hoặc trung bình ( Child-Pugh Ahoặc B ). Một số giải pháp bảo vệ dạ dày ở bệnh nhân điều trị OAC cần được nhấn mạnh vấn đề trongbối cảnh có bệnh gan .
Theo Tổ chức Tim mạch Hoa Kỳ / Đại học Tiêu hóa Hoa Kỳ / Thương Hội Tim mạch Hoa Kỳ khuyến nghị đồng thuận của chuyên viên về giảm rủi ro tiềm ẩn chảy máu đường tiêu hóa trên tương quan đến điều trị chống huyết khối, nên xem xét những thuốc ức chế bơm proton ở bệnh nhân mắc bệnh dạ dày hoặc loét dạ dày khi điều trị thuốc chống huyết khối. Bệnh nhân nên được tư vấn về những mối nguy khốn đơn cử của việc uống rượu đồng thời hoặc sử dụng thuốc chống viêm không steroid. Hạn chế tích hợp OAC với 1 hoặc nhiều thuốc kháng tiểu cầu và với thời hạn chỉ định tối thiểu. Nên thực thi sàng lọc nhiễm trùng Helicobacter pylori nên và điều trị khi thích hợp. Phối hợp sớm với những bác sĩ tiêu hóa hoàn toàn có thể giúp hướng dẫn sàng lọc và can thiệp những tổn thương có rủi ro tiềm ẩn cao ( ví dụ, giãn tĩnh mạch thực quản lớn ) .
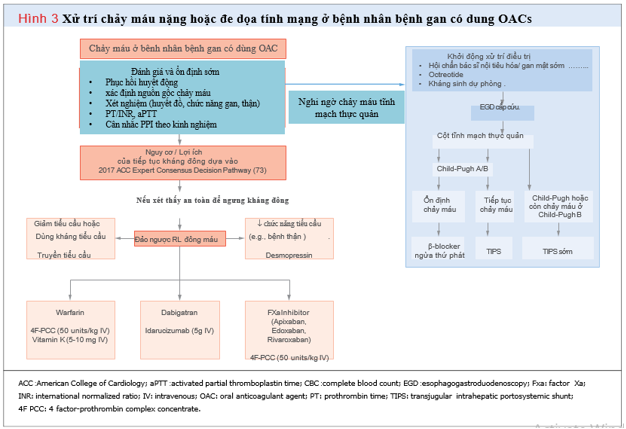
VII. Điều trị chảy máu ở bệnh nhân có bệnh gan đang dùng OACs
Xử trí tối ưu cho bệnh nhân mắc bệnh ganbị chảy máu khi dùng OAC phụ thuộc vào mức độ nghiêm trọng của chảy máu, chỉ định điều trị chống đông máu và nguy cơ huyết khối tiềm ẩn (Hình 3). Cách tiếp cận nên tương tự như ở bệnh nhân không mắc bệnh gan. Quyết định đồng thuận của chuyên gia Tim mạch Hoa Kỳ năm 2017 nhằm mục đích hỗ trợ các bác sĩ lâm sàng trong việc quản lý các biến chứng chảy máu ở bệnh nhân dùng OAC. Theo khuyến cáo, ở những bệnh nhân đang bị chảy máu nghiêm trọng hoặc đe dọa tính mạng mặc dù đã điều trị chuẩn, nên dùng thuốc antidote.
Tác dụng chống đông máu của warfarin có thể dễ dàng được đo bằng chỉ số INR. Đối với những bệnh nhân bị chảy máu đe dọa tính mạng và chỉ số INR> 2, nên sử dụng một loại thuốc cô đặc phức hợp prothrombin yếu tố 4 (PCC) và vitamin K tiêm tĩnh mạch. PCC được ưa thích hơn huyết tương tươi đông lạnh vì hiệu quả tương tự và ít tác dụng phụ hơn, số lượng dịch ít hơn rất nhiều. Theo dõi INR sau đó và tình trạng lâm sàng của bệnh nhân để xác định các yêu cầu tiếp theo đối với PCC hoặc vitamin K.
Ở những bệnh nhân dùng NOAC, các xét nghiệm đông máu chuyên biệt có thể giúp đo lường mức độ chống đông máu. Thời gian Thrombin và thời gian đông máu ecarin (ecarin clotting time) có thể đo lường tác dụng của dabigatran, trong khi đó xét nghiệm calibrated anti-factor Xa chromogenic có thể định lượng tác dụng của apixaban, Rivaroxaban và edoxaban. Tuy nhiên, các xét nghiệm này không có sẵn rộng rãi và không được đề xuất thường xuyên trước khi dùng thuốc đảo ngược. Idarucizumab, một kháng thể đơn dòng kháng dabigatran, được khuyến cáo để đảo ngược tác dụng chống đông máu của dabigatran, chỉ địnhkhi có chảy máu đe dọa tính mạng hoặc không kiểm soát được. Andexanet alfa có tác dụng giải độc đặc trị cho các thuốc ức chế trực tiếp yếu tố Xa edoxaban, Rivaroxaban nhưng chưa có tại Việt Nam. Khi các thuốc giải độc này chưa có sẵn, ở những bệnh nhân bị chảy máu nghiêm trọng hoặc đe dọa tính mạng không đáp ứng với các biện pháp thông thường nên sử dụng PCC 4 yếu tố để đảo ngược tác dụng chống đông máu của thuốc ức chế yếu tố Xa. Nên sử dụng than hoạt tính nếu thuốc chống đông máu được uống trong vòng 2 giờ.
Các chiêu thức điều trị đặc hiệu khác hoàn toàn có thể thích hợp để hạn chế chảy máu ở bệnh nhân mắc bệnh gan. Truyền tiểu cầu hoàn toàn có thể được xem xét ở những bệnh nhân chảy máu tiến triển có số lượng tiểu cầu giảm nặng. Sử dụng sớm những thuốc ức chế bơm proton tiêm tĩnh mạch, octreotide ( một chất tương tự như somatostatin làm giảm áp lực đè nén tĩnh mạch cửa ) và kháng sinh ( như điều trị dự trữ viêm phúc mạc tự phát do vi trùng ) nên xem xét khi thích hợp. Cần xem xét sớm việc nội soi để xử trí chảy máu do giãn tĩnh mạch thực quản. Ở những bệnh nhân mắc bệnh gan có biến chứng hội chứng gan thận dẫn đến hội chứng urê huyết, desmopressin ( một chất kích thích nội mô làm tăng yếu tố VIII và yếu tố von Willebrand ) hoàn toàn có thể sử dụng để cải tổ công dụng tiểu cầu .
VIII. Sử dụng OACs/bệnh nhân bệnh gan trong thực hành.
Do thiếu những khuyến nghị của guideline hướng dẫn hoặc dẫn chứng can đảm và mạnh mẽ từ những thử nghiệm ngẫu nhiên, những bác sĩ lâm sàng nên tuân theo những khuyến nghị lao lý hiện hành tương quan đến việc sử dụng OAC ở bệnh nhân mắc bệnh gan. Các bệnh nhân dự tính dùng OAC trong AF nên được dựa vào thang điểm phân tầng rủi ro tiềm ẩn truyền thống cuội nguồn, như điểm CHA2DS2-VASc, HAS-BLED. Ở toàn bộ những bệnh nhân bệnh gan hoặc có rủi ro tiềm ẩn mắc bệnh gan, nên kiểm tra tính năng gan, số lượng tiểu cầu và xét nghiệm đông máu trước khi khởi đầu OAC và những giá trị phải được theo dõi sát trong quy trình điều trị. Điều trị chống đông máu nên tránh khi có giảm tiểu cầu nặng ( số lượng tiểu cầu IX. Kết luận và những hướng đi trong tương lai:
Bệnh nhân mắc bệnh gan cần điều trị OAC là một thách thức lớn do tăng nguy cơ huyết khối và chảy máu. Quan niệm cũ cho rằng bệnh nhân mắc bệnh gan là được tự động chống đông máu và được bảo vệ khỏi các biến cố huyết khối chưa được chứng minh bằng dữ liệu lâm sàng. Tỷ lệ mắc bệnh tim mạch do chuyển hóa mạn tính ngày càng tăng như béo phì, đái tháo đường, hội chứng chuyển hóa và nghiện rượu mạn tính sẽ làm tăng gánh nặng của bệnh gan mạn tính hơn nữa trên toàn thế giới, đặc biệt là NAFLD. AF và VTE, PVT, là những nguyên nhân chính làm nặng gây trầm trọng ở bệnh nhân mắc bệnh gan. Do đó, một chiến lược chống đông máu tối ưu ở những bệnh nhân mắc bệnh gan với warfarin hoặc NOAC cần phải được xác định rõ hơn.
Nên có sự hợp tác chuyên môn giữa tim mạch, tiêu hóa/ gan và huyết học để hướng dẫn các bác sĩ lâm sàng kê toa OAC cho bệnh nhân mắc bệnh gan. Các thử nghiệm ngẫu nhiên là cần thiết để điều tra sự an toàn và hiệu quả của OAC ở bệnh nhân mắc bệnh gan với một loạt các nguy cơ huyết khối (AF, VTE hoặc PVT). Thử nghiệm CIRROXABAN (Thử nghiệm ngẫu nhiên đa trung tâm về tác dụng của Rivaroxaban đối với sự sống còn và sự phát triển các biến chứng tăng áp cửa ở bệnh nhân xơ gan; NCT02643212) là một thử nghiệm ngẫu nhiên có đối chứng với giả dược đang tiến hành với số lượng mục tiêu là 160 bệnh nhân để đánh giá vai trò của Rivaroxaban trong việc ngăn ngừa các biến chứng huyết khối ở bệnh nhân mắc bệnh gan và tăng áp cửa. Những cách tiếp cận mới về sử dụng các đặc điểm lâm sàng và dấu ấn sinh học nên được phát triển để phân tầng tốt hơn nguy cơ chảy máu và huyết khối ở bệnh nhân mắc bệnh gan cần điều trị OAC.
Tài liệu tham khảo
1. Kuo. L et al: Liver Cirrhosis in Patients With Atrial Fibrillation: Would Oral Anticoagulation Have a Net Clinical Benefit for Stroke Prevention? J Am Heart Assoc. 2017;6: e005307. DOI: 10.1161/JAHA.116.005307.
2. Qamar. A et al: Oral Anticoagulation in Patients With Liver Disease. J Am Coll Cardiol 2018;71: 2162–75.
3. Chokesuwattanaskul. R et al: Efficacy and safety of anticoagulation for atrial fibrillation in patients with cirrhosis: A systematic review and meta-analysis. Digestive and Liver Disease xxx (2018) xxx–xxx.
4. Hum MD. J et al: The efficacy and safety of direct oral anticoagulants vs. traditional anticoagulants in cirrhosis. 2016. doi: 10.1111/ejh.12844
5. Goriacko. P & Veltri. KT: Safety of Direct Oral Anticoagulants versus Warfarin in Patients with Chronic Liver Disease and Atrial Fibrillation. doi: 10.1111/ejh.13045.
6. Hoolwerf. EW et al: Direct oral anticoagulants in patients with liver cirrhosis: A systematic review. Thrombosis Research 170 (2018) 102–108.
7. Lee. HF et al: Effectiveness and Safety of Non–Vitamin K Antagonist Oral Anticoagulant and Warfarin in Cirrhotic Patients With Nonvalvular Atrial Fibrillation. J Am Heart Assoc. 2019;8:e011112. DOI: 10.1161/ JAHA.118.011112.
8. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K
antagonist oral anticoagulants in patients with atrial fibrillation
