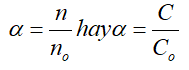Bài tập phương pháp, cách tính pH hay, chi tiết
Trang trước
Trang sau
Quảng cáo
Phương pháp
– Tính số mol H + / OH – hoặc tổng số mol H + / OH –
– Tính nồng độ H + / OH –
– Áp dụng công thức tính pH : pH = – lg [ H + ]
– Nếu là dung dịch bazo ta tính nồng độ OH – pOH pH = 14 pOH
Bài 1: Trộn 10g dung dịch HCl 7,3% với 20g dung dịch H2SO4 4,9% rồi thêm nước để được 100ml dung dịch A. Tính pH của dung dịch A.
Hướng dẫn:
Số mol HCl là nHCl = ( 10.7,3 ) / ( 100.36,5 ) = 0,02 mol
Số mol H2SO4 là nH2SO4 = ( 20.4,9 ) / ( 100.98 ) = 0,01 mol
Phương trình điện ly : HCl H + + Cl –
0,02 0,02 mol
H2SO4 2H + + SO42 –
0,01 0,02 mol
Tổng số mol H + là nH + = 0,02 + 0,02 = 0,04 mol
CM ( H + ) = 0,04 / 0,1 = 0,4 M pH = 0,4
Quảng cáo
Bài 2: Hoà tan 3,66 gam hỗn hợp Na, Ba vào nước dư thu được 800ml dung dịch A và 0,896 lít H2 (đktc). Tính pH của dung dịch A
Hướng dẫn:
nH2 = 0,896 / 22,4 = 0,04 mol
Gọi số mol của Na và Ba lần lượt là x, y mol. Ta có : 23 x + 137 y = 3,66 ( 1 )
Na + H2O NaOH + 50% H2
x x x / 2 mol
Ba + 2H2 O Ba ( OH ) 2 + H2
y y y mol
x / 2 + y = 0,04 ( 2 )
Từ ( 1 ), ( 2 ) ta có : x = 0,04 và y = 0,02
Phương trình điện ly : NaOH Na + + OH –
0,04 0,04 mol
Ba ( OH ) 2 Ba2 + + 2OH –
0,02 0,04 mol
Tổng số mol OH – là : nOH – = 0,08 mol
CM ( OH – ) = 0,08 / 0,8 = 0,1 M pOH = 1 pH = 13
Bài 3: Hòa tan 4,9 mg H2SO4 vào nước thu dược 1 lít dd. pH của dd thu được là:
Hướng dẫn:
nH2SO4 = 4,9 / 98 = 0,05 mol CM ( H2SO4 ) = 5.10 – 5/1 = 5.10 – 5 M
[ H + ] = 10-4 M pH = – log ( 10-4 ) = 4
Quảng cáo
Bài 4: Cho 15 ml dung dịch HNO3 có pH = 2 trung hòa hết 10 ml dung dịch Ba(OH)2 có pH = a. Giá trị của a là:
Hướng dẫn:
nHNO3 = 1,5. 10-2. 10-2 = 1,5. 10-4 nBa ( OH ) 2 = 7,5. 10-5 mol
CM ( OH – ) = 1,5. 10-4 / 10-2 = 1,5. 10-2 pOH = 1,8 pH = 12,2
Bài 5: Hoà tan m gam Zn vào 100 ml dung dịch H2SO4 0,4M thu được 0,784 lít khí hiđro và dung dịch X. Tính pH của dung dịch X?
Hướng dẫn:
nH2 = 0,784 / 22,4 = 0,035 mol mol axit H2SO4 phản ứng là 0,035 mol
Mol axit H2SO4 dư = 0,04 – 0,035 = 0,005 mol [ H + ] = 0,1 pH = 1
Bài 6: A là dung dịch HNO3 0,01M ; B là dung dịch H2SO4 0,005M. Trộn các thể tích bằng nhau của A và B được dung dịch X. Tính pH của dung dịch X
Hướng dẫn:
Tổng mol H + là 0,02 mol [ H + ] = 0,01 pH = 2
Phương pháp
Tương tự như axit mạnh .
Sử dụng phối hợp công thức tính độ điện ly α, hằng số điện ly axit, bazo : Ka, Kb
– Độ điện li α của chất điện li là tỉ số giữa số phân tử phân li ra ion ( n ) và tổng số phân tử hòa tan ( no )
– Hằng số phân li axit : HA H + + A –
( chỉ phụ thuộc vào bản chất axit và nhiệt độ)
– Hằng số phân li bazo : BOH B + + OH –
( chỉ phụ thuộc vào bản chất bazơ và nhiệt độ)
Bài 1: Hoà tan 1,07g NH4Cl vào nước được 2 lít dung dịch X.
a. Tính pH của dung dịch X biết hằng số phân li bazơ của NH3 là 1,8.10-5.
b. Nếu thêm vào dung dịch X 100 ml dd HCl 0,01M được dd Y. Tính pH của dd Y?
Hướng dẫn:
a. nNH4Cl= 1,07/53,5 = 0,02 CM(NH4Cl) = 0,02/2 = 0,01 M
Phương trình điện ly :
NH4Cl NH4 + + Cl –
0,01 0,01
NH4 + + H2O NH3 + H3O +
Ban đầu : 0,01
Điện ly : x .. xx
Sau điện ly : 0,01 – xx. x
Kb = x2 / ( 0,01 – x ) = 1,8. 10-5 x = 4,24. 10-4 pH = 3,37
b. Phương trình điện ly:
HCl H + + Cl –
0,001 0,001
NH4 + + H2O NH3 + H3O +
Ban đầu : 0,01. 0,001
Điện ly : x.xx
Sau điện ly : 0,01 – x xx + 0,001
Kb = x ( x + 0,001 ) / ( 0,01 – x ) = 1,8. 10-5 x = 3,69. 10-4 pH = 3,43
Bài 2: Dung dịch A chứa NH3 0,1M và NaOH 0,1M. Tính pH của dung dịch biết Kb của NH3 = 1,75.10-5.
Hướng dẫn:
NaOH Na + + OH –
0,1 0,1
NH3 + H2O NH4 + + OH –
Ban đầu : 0,1 0,1
Điện ly : x x x
Sau điện ly : 0,1 – x x x + 0,1
Kb = x ( 0,1 + x ) / ( 0,1 – x ) = 1,75. 10-5 x = 1,75. 10-3 pOH = 4,76 pH = 9,24
Bài 3: Tính pH của dd NH3 0,1M, biết Kb của NH3 = 1,8.10-5 và bỏ qua sự phân li của nước
Hướng dẫn:
Kb = x2 / ( 0,1 – x ) = 1,8. 10-5 x = 1,34. 10-3 pOH = 2,87
pH = 11,13
Bài 4: Tính pH của dd CH3COONa 0,5M; biết Kb của CH3COO- = 5,71.10-10 và bỏ qua sự phân li của nước
Hướng dẫn:
Ka = x2 / ( 0,5 – x ) = 5,71. 10-10 x = 1,68. 10-5 pOH = 4,77
pH = 9,23
Bài 5: Cho dd hh X gồm HCl 0,01 M và CH3COOH 0,1M. Biết Ka của CH3COOH = 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dd X là:
Hướng dẫn:
Ka = x ( 0,01 + x ) / ( 0,1 – x ) = 1,75. 10-5 x = 1,75. 10-5 pH = 1,99
Bài 6: Cho dd hh X gồm CH3COOH 0,1M và CH3COONa 0,1M. Biết Ka của CH3COOH = 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dd X là:
Hướng dẫn:
Ka = x ( 0,1 + x ) / ( 0,1 – x ) = 1,75. 10-5 x = 1,75. 10-5 pH = 4,76
Phương pháp
– Tính số mol axit, bazo
– Viết phương trình điện li
– Tính tổng số mol H +, OH –
– Viết phương trình phản ứng trung hòa
– Xác định môi trường tự nhiên của dung dịch dựa vào pH Xem xét mol axit hay bazơ dư tìm những giá trị mà bài toán nhu yếu .
Chú ý : Vdd sau khi trộn = Vaxit + Vbazo
Bài 1: Trộn 3 dung dịch H2SO4 0,1M ; HNO3 0,2M ; HCl 0,3M với thể tích bằng nhau thu được dung dịch A. Lấy 300 ml dung dịch A tác dụng với dung dịch B gồm NaOH 0,2M và Ba(OH)2 0,1M. Tính thể tích dung dịch B cần dùng để sau khi phản ứng kết thúc thu được dung dịch có pH = 1. Coi Ba(OH)2 và H2SO4 phân li hoàn toàn ở 2 nấc.
Hướng dẫn:
Sau khi trộn 3 dung dịch axit có thể tích bằng nhau ta thu được nồng độ mới của 3 axit là: CM(HCl) = 0,1 M; CM(HNO3) = 0,2/3; CM(H2SO4) = 0,1/3. Trong 300 ml dung dịch A: nHCl = 0,03 mol; nH2SO4 = 0,01 mol; nHNO3 = 0,02 mol
Phương trình điện ly :
H2SO4 2H + + SO42 –
0,01. 0,02
HNO3 H + + NO3 –
0,02 .. 0,02
HCl H + + Cl –
0,03 0,03
Tổng mol H + là nH + = 0,07 mol
Gọi x là thể tích của dung dịch B cần dung .
nNaOH = 0,2 x ; nBa ( OH ) 2 = 0,1 x
Phương trình điện ly :
NaOH Na + + OH –
0,2 x .. 0,2 x
Ba ( OH ) 2 Ba2 + + 2OH –
0,1 x. 0,2 x
Tổng số mol OH – là : nOH – = 0,4 x
Ta có : H + + OH – H2O ( Sau phản ứng pH = 1 dư axit )
Ban đầu 0,070,4 x
Pư 0,4 x0, 4 x
Sau pư 0,07 – 0,4 x. 0
( 0,07 – 0,4 x ) / ( x + 0,3 ) = 0,1 x = 0,08 lít
Bài 2: Trộn 100 ml dung dịch có pH =1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a(mol/l) thu được 200 ml dung dịch A có pH = 12.
a. Tính ab. Pha loãng dung dịch A bao nhiêu lần để thu được pH = 11
Hướng dẫn:
a. nH + = 0,01 mol ; nOH – = 0,1 a mol
Ta có : H + + OH – H2O ( Sau phản ứng pH = 12 dư bazo )
Ban đầu 0,010,1 a
Pư 0,010,01
Sau pư 0 ….. 0,01 – 0,1 a
( 0,01 – 0,1 a ) / ( 0,1 + 0,1 ) = 0,01 a = 0,08 lít
b. số mol NaOH dư : nOH – = 0,002 mol
Gọi x là thể tích nước thêm vào .
Dung dịch sau pha loãng có pH = 10 0,002 / ( 0,2 + x ) = 0,001 x = 1,8
Vậy cần phải pha loãng 10 lần .
Bài 3: Tính tỷ lệ thể tích khi dung dịch HCl có pH = 1 và dung dịch HCl pH = 4 cần dùng để pha trộn thành dung dịch có pH = 3.
Hướng dẫn:
Đáp án : 1/110
Bài 4: Cho 100 ml dd hh gồm Ba(OH)2 0,1M và NaOH 0,1M với V ml dd hh gồm H2SO4 0,0375M và HCl 0,0125M thu được dd có pH = 2. Giá trị V là:
Hướng dẫn:
nOH – = 0,03 mol ; nH + = 0,0875 V
Dung dịch sau khi trộn pH = 2 thiên nhiên và môi trường axit .
( 0,0875 V – 0,03 ) / ( 0,1 + V ) = 10-2 V = 0,4 lit
Bài 5: Trộn 300 ml dd hh gồm H2SO4 0,1M và HCl 0,15M với V ml dd hh gồm NaOH 0,3M và Ba(OH)2 0,1M, thu được dd X có pH = 12. Giá trị của V là:
Hướng dẫn:
nOH – = 0,5. V mol ; nH + = 0,0645 V
Dung dịch sau khi trộn pH = 12 môi trường tự nhiên bazo .
( 0,5 V – 0,0645 ) / ( 0,3 + V ) = 10-2 V = 0,15 lit
Bài 1: Câu nào sai khi nói về pH và pOH của dung dịch ?
A. pH = lg[H+] B. pH + pOH = 14
C. [H+].[OH-] = 10-14 D. [H+] = 10-a pH = a
Hiển thị đáp án
Đáp án: A
Bài 2: Dung dịch H2SO4 0,10 M có
A. pH = 1 B. pH C. pH > 1 D. [H+] > 2,0M
Hiển thị đáp án
Đáp án: B
Bài 3: pH của hỗn hợp dung dịch HCl 0,005M và H2SO4 0,0025M là:
A. 2 B. 3 C. 4 D. 12
Hiển thị đáp án
Đáp án: A
Bài 4: pH của dung dịch Ba(OH)2 0,05M là.
A. 13 B. 12 C. 1 D. 11
Hiển thị đáp án
Đáp án: A
Bài 5: Cần bao nhiêu gam NaOH để pha chế 250ml dd có pH = 10
A. 0,1 gam B. 0,01 gam C. 0,001 gam D. 0,0001 gam
Hiển thị đáp án
Đáp án: C
pOH = 4 [ OH – ] = 10-4 nOH – = 0,25. 10-4 = 2,5. 10-5 mol
mNaOH = 2,5. 10-5. 40 = 0,001 gam
Bài 6: Số ml dung dịch NaOH có pH = 12 cần để trung hoà 10ml dung dịch HCl có pH = 1 là
A. 12ml B. 10ml C. 100ml D. 1ml.
Hiển thị đáp án
Đáp án: C
nNaOH = nHCl = 10-3 mol VNaOH = 10-3 / 10-2 = 10-1 ( lít ) = 100 ml )
Bài 7: Trộn 200 ml dung dịch gồm HCl 0,1M và H2SO4 0,15M với 300 ml dung dịch Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A.0,15 và 2,330 B. 0,10 và 6,990.
C.0,10 và 4,660 D. 0.05 và 3,495
Hiển thị đáp án
Đáp án: D
Sau phản ứng trung hòa pH = 1 H + dư
H + + OH – H2O
nH + bđ = 0,08 mol ; sau phản ứng pH = 1
nH + pư = nOH – = 0,03 mol nBa ( OH ) 2 = 0,015 mol
CM Ba ( OH ) 2 = 0,05 M mBaSO4 = 3,495 g
Bài 8: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là
A. 134. B. 147. C. 114. D. 169.
Hiển thị đáp án
Đáp án: A
Coi 300 ml dung dịch A gồm 100 ml H2SO4 0,1 M 100 ml HNO3 0,2 M và 100 ml HCl 0,3 M trộn lại với nhau. Vậy : nH + = 0,07 mol
Phản ứng của dung dịch A và B là : H + + OH – H2O
nH + ( Pư ) = nOH – = 0,49. 0,001 V nH + ( du ) = 0,01. ( 0,3 + 0,001 V )
0,07 = 0,49. 0,001 V + 0,01. ( 0,3 + 0,001 V ) V = 134 ml
Bài 9: Ba dung dịch axit sau có cùng nồng độ mol: HCl, H2SO4, CH3COOH. Giá trị pH của chúng tăng theo thứ tự là
A.HCl, H2SO4, CH3COOH. B.CH3COOH, HCl, H2SO4.
C.H2SO4, HCl, CH3COOH. D.HCl, CH3COOH, H2SO4.
Hiển thị đáp án
Đáp án: A
Bài 10: Dung dịch CH3COOH 0,1M có pH = a và dung dịch HCl 0,1M có pH = b. Phát biểu đúng là
A. a B. a > b = 1. C. a = b = 1. D. a = b > 1.
Hiển thị đáp án
Đáp án: B
Bài 12: Tính pH của dd CH3COOH 0,2M, biết Ka của CH3COOH = 1,75.10-5 và bỏ qua sự phân li của nước
A. 5,46 B. 4,76 C. 2,73 D. 0,7
Hiển thị đáp án
Đáp án: C
Ka = x2 / ( 0,2 – x ) = 1,75. 10-5 x = 1,87. 10-3 pH = 2,73
Bài 13: Cho dd hh X gồm HF 0,09M và KF 0,08M. Biết Ka của HF = 6,5.10-5, bỏ qua sự phân li của nước. Giá trị pH của dd X là:
A. 1,1 B. 4,2 C. 2,5 D. 0,8
Hiển thị đáp án
Đáp án: B
Ka = x ( 0,1 + x ) / ( 0,1 – x ) = 6,5. 10-5 x = 6,5. 10-5 pH = 4,2
Bài 14: Khi pha loãng dung dịch axit HCl có pH = a ta thu được dung dịch mới có
A.pH > a B. pH = a C. pH D. Cả A, B, C đều đúng
Hiển thị đáp án
Đáp án: A
Bài 15: Cần trộn 100 ml dung dịch NaOH có pH = 12 với bao nhiêu ml dung dịch NaOH có pH=10 để thu được dung dịch NaOH có pH = 11.
A.1 B.10 C.100 D.1000.
Hiển thị đáp án
Đáp án: B
Bài 16: Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
Hiển thị đáp án
Đáp án: B
Dung dịch sau khi trộn pH = 6 thiên nhiên và môi trường axit .
( V1. 10-5 – V2. 10-5 ) / ( V1 + V2 ) = 10-6 V1 / V2 = 11/9
Bài 17: Trộn V1 lit dung dịch H2SO4 có pH = 3 với V2 lit dung dịch NaOH có pH = 12 để được dung dịch có pH = 11, thì tỷ lệ V1: V2 có giá trị nào?
A. 9:11 B. 11:9 C. 9:2 D. 2:9
Hiển thị đáp án
Đáp án: C
Bài 17: Dung dịch sau khi trộn pH = 11 môi trường bazơ .
( V2. 10-3 – V1. 10-3 ) / ( V1 + V2 ) = 10-3 V1 / V2 = 9/2
Xem thêm những dạng bài tập Hóa học lớp 11 có trong đề thi THPT Quốc gia khác :
Giới thiệu kênh Youtube Tôi
Trang trước
Trang sau