2012-11-06 11:46 PM
Hầu hết những phản ứng chuyển hóa xảy ra trong khung hình luôn yên cầu một pH thích hơp, trong khi đó phần nhiều những sản phẩm chuyển hóa của nó .
Ý nghĩa của pH máu
Hầu hết các phản ứng chuyển hóa xảy ra trong cơ thể luôn đòi hỏi một pH thích hơp, trong khi đó phần lớn các sản phẩm chuyển hóa của nó lại có tính acid làm cho pH có khuynh hướng giảm xuống. Ví dụ: Sự oxy hóa hoàn toàn chất hydrat carbon và mỡ, mỗi ngày sinh ra khoảng 22.000 mEq CO2. CO2 hóa hợp với nước hình thành acid carbonic (H2CO3). Mặt khác còn có khoảng 70 mEq chất axid cố định (acid không bay hơi) hình thành từ các nguồn chuyển hóa khác: các axid hữu cơ (acid lactic, acid pyruvic, aceton) sinh ra từ sự oxy hóa không hoàn toàn chất hydrat carbon và mỡ và các acid cố định dưới dạng sulfat (từ oxy hóa các acid amin có chứa sulfua), nitrat và photphat (từ oxy hóa các phosphoprotein).
Tuy những chất chuyển hóa acid được hình thành một cách liên tục như vậy nhưng pH của những dịch hữu cơ vẫn ít biến hóa là nhờ khung hình tự duy trì pH bằng những hệ đệm trong và ngoài tế bào, sự đào thải acid của phổi và thận :
Bằng mạng lưới hệ thống đệm huyết tương : Bao gồm hệ đệm HCO3 – / H2CO3, hệ đệm proteine / proteinate và hệ đệm H2PO4 – / HPO42 -. Các hệ đệm này đảm nhiệm 47 % năng lực đệm của toàn khung hình .
Bằng mạng lưới hệ thống đệm của hồng cầu : Bao gồm hệ đệm Hemoglobinate / Hemoglobine, hệ đệm HCO3 – / H2CO3 và hệ đệm phosphate hữu cơ. Các hệ đệm này đảm nhiệm 53 % năng lực đệm còn lại của toàn khung hình .
Đào thải acid bay hơi ( CO2 ) qua phổi .
Đào thải acid không bay hơi qua thận .
Bởi vậy pH huyết tương tương đối hằng định và bằng 7,4 ± 0,05 .
Khái niệm về pH và ion H+
Trong Y học và Sinh học người ta miêu tả sự trao đổi chất acid và base theo khái niệm của Bronstedt. Acid được định nghĩa như thể một chất hoàn toàn có thể giải phóng ion H +, còn chất base là chất hoàn toàn có thể tiếp đón ion H +. Độ acid của một dung dịch được bộc lộ bằng giá trị pH và bằng nghịch dấu logarit của hoạt tính proton :
pH = – logH +
Sự duy trì cân đối acid-base trong số lượng giới hạn thông thường cũng chính là sự duy trì nồng độ ion H + trong số lượng giới hạn thông thường. Dung dịch acid chứa một lượng ion H + cao hơn so với lượng ion OH -, dung dịch base thì ngược lại, còn dung dịch trung tính lượng ion H + và OH – tương dương nhau và bằng 10-7. Chỉ số nồng độ ion H + và OH – trong dung dịch là một hằng số : [ H + ]. [ OH – ] = 10-14 .
Đối với nước nguyên chất, mức phân ly của ion H + và OH – bằng nhau. Nồng độ ion H + tính ra mEq / L là bằng 10-7 ở nhiệt độ 230C. Vậy pH của nước nguyên chất hay của những dung dịch trung tính bằng 7 .
Tuy nhiên trong y học, thuật ngữ acid-base không được hiểu theo nghĩa hóa học tuyệt đối vì những dịch của khung hình đều hơi kiềm. Nồng độ ion H + ( aH + ) trong huyết tương khoảng chừng 0,0004 mEq / L = 4.10 – 5 mEq / L = 4.10 – 8 Eq / L .
Suy ra : pH máu = – log [ H + ] = – ( log 4.10 – 8 ) = 7,398 hay theo phương trình Henderson-Haselbach :
pH = pK + log [ HCO3 – / H2CO3 ] = 6,1 + log 20/1 ≈ 6,1 + 1,3 ≈ 7,4
Trong khung hình ion H + tuần hoàn dưới hai hình thức :
Các ion H + link với những anion bay hơi ( HCO3 – ) chịu nghĩa vụ và trách nhiệm chính về những rối loạn cân đối acid-base kiểu hô hấp .
Các ion H + link với những anion cố định và thắt chặt, không bay hơi ( SO42 -, PO43 -, lactat, … ) chịu nghĩa vụ và trách nhiệm chính về những rối loạn cân đối acid – base kiểu chuyển hóa .
Khái niệm về kiềm dư (BE: base excess)
Là lượng kiềm chênh lệch giữa kiềm đệm mà tất cả chúng ta đo được và kiềm đệm thông thường. Nó đặc trưng cho lượng kiềm thừa hoặc thiếu để máu bệnh nhân hoàn toàn có thể trở về trạng thái cân đối acid – base thông thường .
BE máu là nồng độ base của máu toàn phần được đo bởi chuẩn độ so với một acid mạnh để pH bằng 7,4 ở PCO2 40 mmHg và nhiệt độ 37 oC. Đối với một chuẩn độ có giá trị âm thì được thực thi với một base mạnh. BE được tính bằng mmol / l ( hoặc mEq / l ), nhằm mục đích để đo sự thừa hoặc thiếu H2CO3. Giá trị thông thường từ – 1 đến + 2 mmol / l và nó biểu lộ cho năng lực cặn của đệm và được tính bằng :
BE = ( HCO3 – – 24,2 ) + 16,2 ( pH – 7,4 )
Khi giá trị pH của một mẫu máu ở nhiệt độ 37 oC có PCO2 là 40 mmHg bằng 7,4 và HCO3 – bằng 24,2 mmol / l thì giá trị tìm hiểu thêm của BE bằng 0 mmol / l. Khi giá trị pH của tác dụng này dưới 7,4 thì BE sẽ âm và trên 7,4 thì BE sẽ dương .
16,2 mmol / l là năng lực đệm của đệm không phải bicarbonat trong dịch ngoại bào. BE là một chỉ số quan trọng trong rối loạn cân đối acid – base. BE dương trong nhiễm toan hô hấp và nhiễm kiềm chuyển hóa. BE âm trong nhiễm toan chuyển hóa và nhiễm kiềm hô hấp .
Khái niệm về khoảng trống anion
Khoảng trống anion máu ( Anion Gap: AG )
Khoảng trống anion máu được coi là những anion không định lượng của huyết tương, thông thường khoảng chừng 12-18 mmol / l. Các anion không được định lượng gồm có : anion Protein, những phosphat, những sulfat, những anion hữu cơ .
Công thức đơn thuần để tính : AG = [ Na + – ( Cl – + HCO3 – ) ]
Khi những anion acid như acetoacetat và những lactat ngày càng tăng trong dịch ngoại bào, khoảng trống anion tăng gây nhiễm toan với AG tăng .
Tăng AG : thường do tăng anion không định lượng được và rất ít gặp do giảm những cation không định lượng được ( Ca + +, Mg + +, K + ). AG cũng hoàn toàn có thể tăng với tăng anion albumin, hoặc do tăng nồng độ albumin, hoặc do nhiễm kiềm làm biến hóa điện tích albumin .
Giảm AG : hoàn toàn có thể do :
Tăng những cation không định lượng được .
Hiện diện trong máu những cation không bình thường như lithium ( nhiễm độc lithium ) hoặc cation immunoglobulin ( gặp trong bệnh loạn tương bào ) .
Giảm trong huyết tương anion albumin ( hội chứng thận hư ) .
Giảm điện tích hiệu suất cao anion của albumin bởi nhiễm toan .
Bệnh nhầy nhớt và tăng lipid máu nặng .
Khi albumin máu thông thường, AG tăng thường là do sự hiện hữu của acid không chứa Cl – như những anion : không phải hữu cơ ( photphat, sulfat ), hữu cơ : ketosis, lactate, những anion hữu cơ urê, ngoại sinh ( salicylat hoặc nhiễm độc những loại sản phẩm acid hữu cơ ) hoặc không xác lập được .
Theo định nghĩa nhiễm toan AG tăng có 2 đặc tính : HCO3 – giảm và AG tăng
Khái niệm về khoảng trống anion niệu( UAG: Urine Anion Gap)
Khoảng trống anion niệu được tính bằng : UAG = [ ( Na + + K + ) / niệu – ( Cl – ) / niệu ] .
Khoảng trống anion niệu được cho phép người ta ước tính được nồng độ NH4 + niệu. NH4 + hoàn toàn có thể xem như một chất kiềm hữu cơ có năng lực trung hòa acid mà không cần tới Na +, K +. Vì vậy nồng độ NH4 + niệu nói lên năng lực đệm của thận. Khi ( Cl – ) / niệu > ( Na + + K + ) / niệu thì NH3 + niệu sẽ được tăng lên theo phương pháp thích hợp, gợi ý một nguyên do nhiễm toan ngoài thận. Thật vậy trong ỉa lỏng, do mất HCO3 – qua phân nên đưa đến nhiễm toan chuyển hóa. Thay vì pH nước tiểu acid ( như trong nhiễm toan mạng lưới hệ thống ), pH nước tiểu acid thường chung quanh 6 vì nhiễm toan chuyển hóa và giảm K + máu làm tăng tổng hợp và bài tiết NH4 + qua thận ; như thế gây ra một đệm nước tiểu làm tăng pH nước tiểu. Như vậy sự bài tiết NH4 qua nước tiểu tăng cao trong ỉa lỏng và thấp trong nhiễm toan do ống thận ( RTA : renal tubular acidosis ). Những không bình thường trong nhiễm toan do ống thận xa cổ xưa ( type I ) là giảm K + máu, nhiễm toan tăng Cl -, giảm bài tiết NH4 + qua nước tiểu ( UAG +, NH4 + niệu giảm ) và pH niệu tăng theo phương pháp không thích hợp ( pH > 5,5 ). Bệnh nhân này không có năng lực toan hóa nước tiểu của họ xuống dưới 5,5. Thường có giảm citrat niệu, tăng calci niệu đưa đến rỗ xương. Trong RTA type IV, tăng K + máu không tỷ suất với so với giảm GFR do cùng sống sót rối loạn tính năng bài tiết K + và acid .
Các hệ thống điều hòa pH
Điều hòa do hệ thống đệm
Nguyên tắc hoạt động giải trí :
Một mạng lưới hệ thống có năng lực giữ cho pH của dung dịch ít biến hóa khi cho thêm vào dung dịch ion H + hoặc OH – thì gọi là mạng lưới hệ thống đệm. Hệ thống này khi nào cũng có đủ hai thành phần : một acid yếu và một muối của base mạnh hoặc một base yếu với muối của nó với một acid mạnh. Ví dụ hệ đệm bicarbonat gồm H2CO3 / NaHCO3 ( acid yếu : H2CO3 ) / muối của base mạnh : NaOH ), hệ đệm NH4OH / NH4Cl ( base yếu : NH4OH / muối của acid mạnh : HCl ) .
Tính chất hoạt động giải trí của hệ đệm phụ thuộc vào vào mức độ phân ly của nó trong dung dịch. Mỗi mạng lưới hệ thống đệm đều có một hằng số phân ly riêng và được biểu lộ bằng logarit trái dấu tức pK. PK càng nhỏ thì càng dễ phân ly và ngược lại, hệ đệm nào có pK càng gần pH thì hoạt động giải trí càng có hiệu suất cao .
Trong một mạng lưới hệ thống đệm nhất định khi lượng ion H + phân ly và lượng ion H + tích hợp bằng nhau và bằng 50 % thì người ta nhận thấy pH của hệ đệm không biến hóa nên gọi là pK của mạng lưới hệ thống ấy ( tức pH = pK ) .
Theo phương trình Henderson – Hassenbach :
pH = pK + log [ A – / A – H + ]
A là hình thái tích hợp, A – H + là hình thái phân ly của hệ đệm .
Các mạng lưới hệ thống đệm chính :
Hệ đệm bicarbonat : NaHCO3 / H2CO3 = HCO3 – / HCO3 – H + :
Hệ đệm này đảm nhiệm 43 % năng lực đệm của toàn khung hình, trong đó ngoại bào 33 % và nội bào 10 %. Đây là một hệ đệm rất quan trọng và rất linh động, là hệ đệm chính của ngoại bào vì :
Nồng độ ion bicarbonat dưới hình thái phối hợp NaHCO3 trong huyết tương cao. Bình thường nó được thận đào thải hoặc tái hấp thu tiếp tục để có nồng độ không thay đổi trong huyết tương là 27 mEq / L ( còn gọi là dự trữ kiềm ) .
Acid carbonic là một acid bay hơi hoàn toàn có thể tăng giảm nồng độ một cách nhanh gọn nhờ hoạt động giải trí của phổi ( tăng hoặc giảm thông khí ) để có nồng độ không thay đổi trong huyết tương là 1,35 mEq / L .
Theo phương trình Henderson-Haselbach:
pH = pK + log [ NaHCO3 / H2CO3 ] = pK + log HCO3 – / aPCO2
= 6,1 + log 27/1, 25 = 6,1 + log 20 ≈ 6,1 + 1,3 ≈ 7,4
Như vậy, sau khi hệ bicarbonat đã đệm rồi thì pH của dịch ngoại bào cũng chỉ giao động chung quanh 7,4 mà thôi .
Hệ đệm photphat : Na2HPO4 / NaH2PO4 = NaHPO4 – / NaHPO4-H +
Đảm nhiệm 7 % năng lực đệm của khung hình, là một hệ đệm của nội bào ( PO43 – nội bào = 140 mEq / L ) và của nước tiểu, có hiệu suất lớn vì pK bằng 6,8 gần với pH sinh lý .
Hệ đệm proteine / proteinate :
Đây cũng là một mạng lưới hệ thống đệm của huyết tương, đảm nhiệm 12 % năng lực đệm của khung hình. Hệ đệm proteinat bằng những gốc amin và gốc carboxyl của nó ( NH3 + – R – COO – ) .
Ở điểm đẳng điện, số điện tích dương và âm bằng nhau. Thêm ion H +, protein sẽ tích điện dương và chuyển sang phía acid của điểm đẳng điện. Khi mất H +, protein tích điện âm và chuyển sang phía base của điểm đẳng điện. Như vậy trong thiên nhiên và môi trường acid, protein bộc lộ tính kiềm và ngược lại .
Hệ đệm Hemoglobinate / Hemoglobine :
Gồm hệ hemoglobinat Hb – / Hb – H + và Oxy hemoglobinat HbO – / HbO – H + .
Đây là hệ đệm của hồng cầu, có hàm lượng rất lớn nên chúng có vai trò quan trọng trong điều hòa pH máu qua sự bắt giữ và đào thải CO2 ở phổi. Hệ đệm này đảm nhiệm 36 % năng lực đệm của toàn khung hình .

Bảng : Hoạt tính của những hệ đệm ( % ) trong điều hòa cân đối acid – base .
Tóm lại, những mạng lưới hệ thống đệm của khung hình can thiệp rất sớm vào việc duy trì cân đối acid – base trong số lượng giới hạn thông thường mà hiệu suất cao đệm nhờ vào đa phần vào hệ đệm bicarbonat ( qua hệ đệm này, hiệu lực thực thi hiện hành của những hệ đệm khác cũng được phản ảnh đúng, thế cho nên những thống kê giám sát đa phần là suy luận trên hệ đệm bicarbonat ). Các thành phần của hệ đệm bị hao hụt do tính năng trung hòa sẽ được tái phục sinh nhờ vào những hoạt động giải trí tích cực của phổi và thận .
Điều hòa do hô hấp
Khi cơ thể tích nhiều CO2 sẽ làm pH giảm, pH giảm tới 7,33 là TT hô hấp bị kích thích mạnh dẫn tới tăng thông khí, nhờ vậy CO2 được đào thải ra ngoài cho tới khi tỉ lệ H2CO3 trên NaHCO3 quay trở lại giá trị 1/20. Ngược lại khi H2CO3 giảm hoặc NaHCO3 tăng, pH sẽ có xu thế tăng thì TT hô hấp sẽ bị ức chế dẫn tới thở chậm, CO2 tích lại cho đến khi tỷ số nâng lên đến 1/20. Dĩ nhiên để bảo vệ đào thải CO2 được tốt thì không những hoạt động giải trí của TT hô hấp mà cả hệ hô hấp và tuần hoàn cũng như số lượng và chất lượng Hb cũng phải thông thường .
Trung tâm hô hấp rất nhạy cảm với nồng độ CO2 trong máu : một sự ngày càng tăng 0,3 % pCO2 trong máu động mạch sẽ làm tăng tần số hô hấp lên gấp đôi và ngược lại nếu pCO2 giảm thì tần số hô hấp giảm. Điều hòa hô hấp là bảo vệ tiên phong của khung hình nhằm mục đích hạn chế những biến thiên của pH máu bằng cách đổi khác tỷ suất acid carbonic trong máu qua sự tăng hay giảm thông khí phổi được tinh chỉnh và điều khiển bởi TT hô hấp và bởi những thụ thể hoá học .
Cần chú ý quan tâm rằng áp lực đè nén riêng phần của CO2 trong phế nang bằng với áp lực đè nén riêng phần của nó trong máu động mạch vì CO2 từ máu tĩnh mạch đến phổi khuyếch tán rất nhanh qua màng phế nang và có xu thế cân đối áp lực đè nén ở hai bên màng. Người ta còn dùng pCO2 để biểu lộ cho nồng độ H2CO3 trong máu vì khi CO2 vào máu ngay lập tức sẽ bị hydrat hóa thành acid carbonic : CO2 + H2O ⇒ H2CO3 ( mmol / L ) = a. pCO2 ( mmHg )
a là thông số hòa tan và bằng 0,0308
Từ phương trình Henderson-Hasselbach ( pH = 6,1 + log [ HCO3 / a. pCO2 ] ) ta thấy pH nhờ vào vào tỷ suất HCO3 – / a. pCO3
Trong nhiễm acid chuyển hóa, NaHCO3 giảm ; để hạn chế sự xê dịch của pH, hô hấp sẽ điều hòa bằng cách tăng thông khí để tăng thải CO2 với mục tiêu giảm H2CO3 trong máu để giữ tỷ HCO3 – / H2CO3 không đổi ( 20/1 ), điều nầy có nghĩa là sẽ giữ được pH không đổi .
Trong nhiễm base chuyển hóa, NaHCO3 tăng. Hô hấp sẽ điều hòa bằng cách giảm thông khí nhằm mục đích giữ CO2 để tăng H2CO3 trong máu nhằm mục đích giữ tỷ HCO3 – / H2CO3 không đổi ( 20/1 ). Như thế sẽ giữ pH ít bị biến hóa .
Lượng CO2 do tế bào sinh ra khoảng chừng 800 – 900 g mỗi ngày cùng với lượng H2CO3 sinh ra do phản ứng đệm sẽ được mạng lưới hệ thống đệm Hb của hồng cầu phối hợp với hệ bicarbonat làm trung hòa và đem thải qua phổi .
Cơ chế tích hợp và phân ly của CO2 và O2 với Hb dựa vào đặc thù acid của HHb, H2CO3 và HHbO2 không được ngang bằng với nhau, trong đó HHb Điều hòa do thận
Thận không tham gia chống lại thực trạng rối loạn cân đối acid – base ngay từ lúc bắt đầu mà chỉ sau nhiều giờ thận mới tự kiểm soát và điều chỉnh. pH chỉ thực sự trở lại sinh lý thông thường sau khi đã có sự kiểm soát và điều chỉnh của thận. Bình thường thận hoàn toàn có thể bài xuất hoặc giữ một cách rất uyển chuyển ion H + cũng như những ion khác. Ta biết một chính sách ăn thông thường sẽ sản xuất những acid thừa ( thừa ion H + ) làm tăng độ acid của nước tiểu lên một cách nguy khốn. Mặt khác, nếu lượng acid thừa này được bài xuất dưới dạng muối natri trung tính thì khung hình sẽ mất nhanh gọn cation chính của dịch ngoại bào hệ quả sẽ làm giảm thể tích ngoại bào. Vì vậy, thận phải nhờ những chính sách ưu việt khác để bài xuất những acid thừa ra khỏi khung hình .
Thận thải chất acid thừa
Khi nhiễm acid thận điều hòa bằng cách bài xuất ion H +, giữ lại những cation kiềm ( K +, Na + ) và anion đệm ( H2CO3 – ). Trong những điều kiện kèm theo thông thường thận hoàn toàn có thể bài xuất từ 50-70 mEq H + trong 24 giờ và làm cho pH của nước tiểu giảm xuống đến 4,5 bằng cách :
Thải H + dưới dạng acid chuẩn độ :
Thận sửa chữa thay thế những ion Na + bằng những ion H + của phân tử Na2HPO4 thành NaH2PO4 tức bài xuất photphat dưới dạng trạng thái nhiễm acid ( monosodic phosphate ) thay cho photphat dưới dạng kiềm ( disodic phosphate ). Tính acid chuẩn độ là số lượng ion H + đã bài xuất thay cho Na + từ Na2HPO4 và giám sát theo cách chuẩn độ nước tiểu bằng dung dịch natri dexinoman ( N / 10 ) và đưa pH nước tiểu lên bằng pH máu ( 7,4 ) .
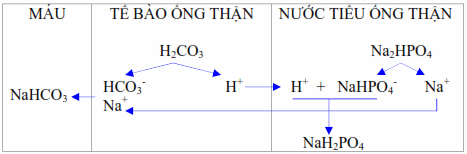
Hình. Thận thải H + dưới dạng axit chuẩn độ .
Lượng ion H + bài xuất dưới dạng này chiếm khoảng chừng 1/3 lượng H + cần đào thải .
Thải H + dưới dạng ion amoni ( NH4 + ) .
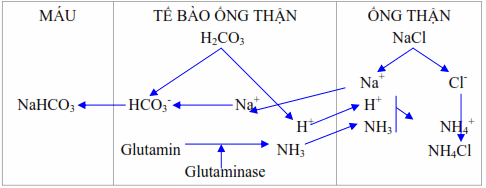
Hình : Thận thải H + dưới dạng ion amoni .
Ở những tế bào ống góp và ống xa tạo ra 30-50 mEq NH3 mỗi ngày từ glutamine, alanin, histidin. Amoniac khuếch tán vào trong nước tiểu acid, tại đây NH3 biến hóa thành ion NH4 + nhờ tích hợp với một ion H +. Do ion NH4 + không khuếch tán qua màng sinh học nên chúng không hề khuếch tán ngược trở lại vào tế bào ống thận và được bài xuất sửa chữa thay thế cho những ion Na +, K + .
Lượng H + được bài xuất dưới dạng này chiếm đến 2/3 lượng H + cần đào thải .
Tái hấp thu trọn vẹn Natri bicarbonat :
Số lượng ion HCO3 – do cầu thận lọc ra được hấp thu vào những ống thận đạt tới khoảng chừng 28 mEq / l. Trong những tế bào ống thận, acid carbonic bị ion hóa thành H + và HCO -. H + được đào thải qua nước tiểu trao đổi với Na + theo chính sách một đổi một nhờ vậy mà tái lập được dự trữ kiềm cho khung hình .
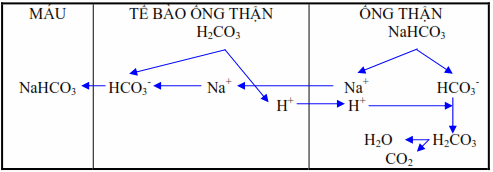
Hình : Thận tái hấp thu trọn vẹn Natri bicarbonat .
Enzym carbonic anhydrase có vai trò quyết định hành động sự hydrat hóa CO2 thành H2CO3 trong tế bào ống thận. Trong nước tiểu thì ngược lại, H2CO3 bị phân ly thành CO2 và H2O, nhờ phản ứng này nên cản trở được sự tích lũy H + trong nước tiểu ống lượn gần tạo điều kiện kèm theo cho sự trao đổi giữa những ion H + và giữa những gradient thấp của H +. Ở cuối ống lượng gần, NaHCO3 được hấp thu với tỷ suất 90 % so với NaHCO3 được lọc và ở ống lượng xa, lượng NaHCO3 đã bị hạ thấp này lại còn được liên tục tái hấp thu nữa .
Thận thải chất base thừa
Thận có xu thế thay thế sửa chữa trạng thái nhiễm base bằng cách bài xuất ion HCO3 – làm cho pH của nước tiểu kiềm hóa đến mức 7,8 bằng cách :
Ức chế hiện tượng kỳ lạ tái hấp thu NaHCO3 ở ống thận .
Thải phophat dưới dạng Na2HPO4 .
Giảm tạo ion NH4 + .
Điều hòa do trao đổi ion giữa nội và ngoại bào
Các cation
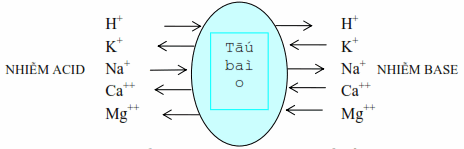
Hình: Trao đổi ion giữa nội và ngoại bào để điều hoà pH.
Sự quá tải ion H + của dịch ngoại bào có khuynh hướng được bù bởi sự vận động và di chuyển của H + từ khu vực ngoại bào sang khu vực nội bào, ở đây H + được bắt giữ bởi những chất đệm, đồng thời hoán đổi với Na + và K + từ nội ra ngoại bào làm tăng K + máu do chuyển vận. Cứ 3 ion K + giải phóng từ tế bào ra sẽ được thay thế sửa chữa bằng 2 ion Na + và 1 ion H +. Ngược lại, khi bị nhiễm base, H + ra khỏi nội bào hoán đổi với Na + và K + làm giảm K + máu. Những trao đổi ion nầy rất khắt khe biểu lộ qua mối đối sánh tương quan rõ ràng giữa những biến hóa nồng độ K + và đổi khác pH của ngoại bào. Mọi sự ngày càng tăng pH thêm 0,1 đơn vị chức năng kéo theo một sự sút giảm từ 0,5 – 0,7 mEq / L kali và ngược lại .
Các anion
Việc CO2 vào hồng cầu có kèm sự vận động và di chuyển của HCO3 + từ hồng cầu sang huyết tương còn Cl – thì từ huyết tương đi vào hồng cầu ( hiện tượng kỳ lạ Hamberger ). Cơ chế là do CO2 khi vào hồng cầu nhờ enzym carbonic anhydrase hydrat hóa thành H2CO3 rồi phân ly thành H + và HCO -. Ion H + dược Hb đệm, trong khi HCO3 – ra lại huyết tương 70 % do sự chên lệch về nồng độ nhưng vì gặp phải sức hút của những cation trong hồng cầu nên nó chỉ được ra khỏi hồng cầu khi có một số lượng tương tự Cl – từ huyết tương vào thay thế sửa chữa cho nó để cân đối điện tích. Điều này lý giải tại sao Cl – máu tĩnh mạch thấp và hồng cầu ở tĩnh mạch lại to hơn ( do có nhiều ion nên hồng cầu tăng giữ nước và trương lên ) .
